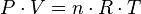COMIENZOS DE LA QUIMICA
Las primeras experiencias del hombre como químico se dieron con la utilización del fuego en la transformación de la materia, la obtención de hierro a partir del mineral y de vidrio a partir de arena son claros ejemplos. Poco a poco el hombre se dio cuenta de que otras sustancias también tienen este poder de transformación. Se dedicó un gran empeño en buscar una sustancia que transformara un metal en oro, lo que llevó a la creación de la alquimia. La acumulación de experiencias alquimia jugó un papel vital en el futuro establecimiento de la química.
Antoine Lavoisier, considerado el padre de la química moderna |
Avogradro
I UNIDAD: MODELOS ESTRUCTURALES
FUNDAMENTALES DE LA MATERIA
LA MATERIA Y SUS PROPIEDADES
También decimos que la materia es todo aquello que ocupa un lugar en el espacio. Se considera que es lo que forma la parte sensible de los objetos palpables o detectables por medios físicos.
Pero tambien nos podemos preguntar que aquellos objetos lo conforman, por ejemplo una pared; está formada por bloques, los bloques están formados por arena, cemento y piedras pequeñas. Si nos fijamos en un granito de arena, este se compone de otras partículas minúsculas llamadas moléculas que están formadas por grupos de átomos.
La fuerza entre los átomos es la razón por la cual el agua cambia de estado. Si la fuerza entre sus átomos es grande, el agua es sólida como el hielo. Si la fuerza entre sus átomos es débil, el agua se convierte en vapor.
 El átomo es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
El átomo es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos. Elementos y Compuestos: el agua es un compuesto, porque dentro de cada una de sus moléculas tiene 2 tipos de átomos diferentes, oxigeno e hidrógeno. La madera también tiene varios tipos de elementos en su interior.
EL ESTADO
La materia se presenta de varias maneras y formas. El color, el olor y la textura son propiedades de la materia que nos ayudan a diferenciarlos.
Llamamos estado a la manera en que se presenta la materia. Estos pueden ser:

| Sólido, tiene una forma definida, como la madera y el cobre. Sus moléculas no cambian de posición. Líquido, no tiene una forma definida, como el agua y el aceite. Sus moléculas pueden cambiar de posición. Gaseoso, no tiene una forma definida, como el aire y el vapor de agua. Sus moléculas cambian libremente de posición. |
Plasma, tampoco tiene una forma definida, un tipo de gas ionizado que sólo existe de forma natural en el sol, estrellas y en el espacio sideral o en condiciones especiales en la tierra.
CLASIFICAION DE LA MATERIA SEGÚN SU COMPOSICIÓN QUIMICA
Las sustancias pueden ser: sustancias puras y mezclas.
Las Sustancias Puras son una manifestación más o menos sofisticada de la materia y la comprensión del concepto se alcanza luego de un estudio breve de los diferentes sistemas materiales.
Clasificación de las sustancias puras:Las sustancias puras se clasifican en dos tipos: elementos y compuestos; ambos son homogéneos ya que mantienen sus propiedades características.
Los elementos Son también denominados sustancias simples elementales que constituyen la materia. Se combinan para formar los compuestos. Los compuestos son denominados también Sustancias Compuestas; están formados por dos o más elementos unidos químicamente en proporciones fijas de masa. |
Los compuestos son muy abundantes en la naturaleza, pero también son sintetizados en el laboratorio. Los compuestos pueden descomponerse en sus elementos constitutivos o sustancias simples empleando técnicas específicas de separación. Ejemplos de sustancias puras.
ELEMENTOS | COMPUESTOS | |
Metales | No metales | |
Hierro (Fe) | Oxígeno (O) | Oxido de Aluminio ( |
Sodio (Na) | Hidrógeno (H) | Anhídrido Carbónico ( |
Aluminio (Al) | Cloro (Cl) | Acido Clorhídrico (HCl) |
Cobre (Cu) | Azufre (S) | Hidróxido de Sodio (NaOH) |
Zinc (Zn) | Fósforo(P) | Sulfato Cúprico ( |
LAS MEZCLAS
La mezcla es un material formado por la unión de dos o más sustancias en proporciones variables y que cumplen con las siguientes condiciones:
° Conservan sus propiedades.
° Sonseparables por medios fisicos o mecanicos.
° Pueden interbenir en cualquier proporcion.
° En su formacion, no presentan manifestaciones energeticas.
Tipos de mezclas: Las mezclas pueden ser homogeneas o heterogeneas.
1.Mezclas homogéneas: Son las que tienen partículas indistinguibles a simple vista o con el microscopio; por ejemplo:
Los coloides: son partículas con un tamaño que oscila entre 10 -7 y 10 -5 cm. Estas mezclas tienen una fase dispersante (disolvente) y una fase dispersa (soluto); ejemplo: leche, gelatina, quesos, etc.
Las soluciones: tienen un tamaño de partícula menor de 10 8 cm. y sus componentes son soluto y solvente. El soluto se disuelve en el solvente y se encuentra, generalmente, en menor proporción que éste.; ejemplo: agua de mar, limonada, te, refrescos, alcohol, etc.
Tecnicas de separacion de un sistema homogeneo:
Destilación: consiste en separar dos líquidos con diferentes puntos de ebullición por medio del calentamiento y posterior condensación de las sustancias. El proceso de la destilación consta de dos fases: la primera en la cual el líquido pasa a vapor, y la segunda en la cual el vapor se condensa y pasa nuevamente a líquido.
Cristalización: consiste en purificar una sustancia sólida; esto se realiza disolviendo el sólido en un disolvente caliente en el cual los contaminantes no sean solubles; luego se filtra en caliente para eliminar las impurezas y después se deja enfriar el líquido lentamente hasta que se formen los cristales.
2.Mezclas heterogeneas: son aquellas en las cuales pueden reconocerse sus diversos componentes debido a la diferencia de sus propiedades. Hay dos tipos de mezclas heterogéneas: mezclas groseras y suspensiones.
Mezclas groseras: Son aquellas que tienen componentes diferenciables por su gran tamaño. Por ejemplo: granito (mica, cuarzo y feldespato.
Suspensiones: Son las que tienen partículas finas suspendidas en agua u otro líquido por un tiempo y luego se sedimentan; por ejemplo: arena y agua.
Filtración: consiste en separar los componentes de una mezcla de dos fases: sólida y líquida, utilizando una membrana permeable llamada medio filtrante, a través de la cual se hace pasar la mezcla; la fase líquida pasa a través de la membrana y la fase sólida queda retenida en ella.
Decantación:
se utiliza para separar dos líquidos con diferentes densidades o una mezcla constituida por un sólido insoluble en un líquido. Si tenemos una mezcla de sólido y un líquido que no disuelve dicho sólido, se deja reposar la mezcla y el sólido va al fondo del recipiente. Si se trata de dos líquidos se coloca la mezcla en un embudo de decantación, se deja reposar y el líquido más denso queda en la parte inferior del embudo.
Centrifugación: consiste en la separación de materiales de diferentes densidades que componen una mezcla. Para esto se coloca la mezcla dentro de un aparato llamado centrífuga, la cual tienen un movimiento de rotación constante y rápido, lo cual hace que las partículas de mayor densidad vayan al fondo y las más livianas queden en la parte superior.
II UNIDAD: ESTRUCTURA DEL NÚCLEO ATÓMICO
Un átomo es una estructura microscópica encontrada en toda la materia ordinaria alrededor de nosotros. Los átomos se componen de 3 tipos de partículas subatomicas:
La partícula subatomica es una partícula más pequeña que un átomo. Éstos incluyen componentes atómicos tales como electrones, los protones, y los neutrones (los protones y los neutrones son realmente partículas compuestas, compuestas de quarks), tan bien como las partículas producidas por radiativo y los procesos de la dispersión, tales como fotones, los neutrinos, y los muons.
Electrones: El electrón (del griego ámbar), comúnmente representado por el símbolo: e−, es una partícula subatómica de tipo fermiónico. En un átomo los electrones rodean el núcleo.
Los electrones tienen una masa pequeña respecto al protón, y su movimiento genera corriente eléctrica negativa, la masa es de 9.11 x 10-28 gramos.
Neutrones: El neutrón es una partícula sin carga neta, presente en el núcleo atómico de prácticamente todos los átomos, excepto el protio. Aunque se dice que el neutrón no tiene carga, en realidad está compuesto por tres partículas fundamentales cargadas llamadas quarks, cuyas cargas sumadas son cero. Por tanto, el neutrón es un barió, neutro compuesto por dos quarks de tipo abajo, y un quark de tipo arriba. Su masa es de 1,674 927 29(28)×10−27 kg.
Protones: En física, el protón (del griego , ['primero']) es una partícula subatómica con una carga eléctrica elemental positiva y una masa 1.836 veces superior a la de un electrón. Experimentalmente, se observa el protón como estable, con un límite inferior en su vida media de unos 1035 años, aunque algunas teorías predicen que el protón puede desintegrarse en otras partículas. El protón y el neutrón, en conjunto, se conocen como nucleones, ya que conforman el núcleo de los átomos.
NOMENCLATURA PARA SISTEMAS ATOMICOS Y SUS MODIFICACIONES.
La nomenclatura química (del latín nomenclatūra) es un conjunto de reglas o fórmulas que se utilizan para nombrar todos los elementos y los compuestos químicos. Actualmente la IUPAC (Unión Internacional de Química Pura y Aplicada, en inglés International Union of Pure and Applied Chemistry) es la máxima autoridad en materia de nomenclatura química, la cual se encarga de establecer las reglas correspondientes.
NUMERO MÁSICO CARGA ELÉCTRICA O ESTADO DE OXIDACIÓN
A CARGA
SÍMBOLO S
NÚMERO ATÓMICO ATOMICIDAD Z
X
DEFINICIONES
NÚMERO ATÓMICO = NÚMERO DE PROTONES = Z
NÚMERO MÁSICO = NÚMERO DE PROTONES + NÚMERO DE NEUTRONES = A
CARGA ELECTRICA = NÚMERO DE PROTONES - NÚMERO DE ELECTRONES
Iones
Un ión es una especie cargar formada a partir de átomos o moleculas neutra que han ganado o perdido electrones como resultado de un cambio quimico. La pérdida de uno o más electron a partir de un átomo neutro forma un catión, un ión con carga neta positiva. Por ejemplo un átomo de sodio (Na) fácilmente puede perder u electron para formar el catión sodio, que se representa por Na+,
por otra parte, un anión es un ión cuya carga neta es negativa debido a un incremento en el número de electrones. Por ejemplo, un átomo de cloro (Cl) puede ganar un electron para formar el ión cloruro Cl-.
Se dece que el cloruro de sodio (NaCl), la sal común de mesa, es un compuesto iónico, porque está formado por cationes y aniones.
LAS PARTICULAS INTRATOMICAS FUNDAMENTALES Rutherford, bombardea una lámina de oro, con rayos a ( partículas "pesadas", cargadas positivamente)
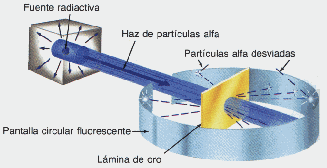
Experimento de Rutherford
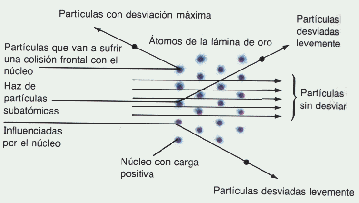
Dispersión de los rayos a por lámina de oro
Rutherford concluye que la lámina de oro es prácticamente vacía, o mejor, el átomo de oro concentra toda su masa en un núcleo de carga positiva de volumen muy pequeño en relación al volumen atómico total.
Comprende la presencia en el núcleo del átomo, de los protones, partículas cargadas positivamente y de masa mayor que la del electrón y que ya habían sido detectadas con el tubo de Thompson. También se comprende la presencia en el nucleo de los neutrones, partículas de igual masa que el protón pero sin carga eléctrica.
El nucleo, por la presencia de los protones, tiene carga positiva y por esta razón atrae los electrones (cargas negativas) que giran a su alrededor en órbitas semejantes, en una primera aproximación a las órbitas planetarias del sistema solar.
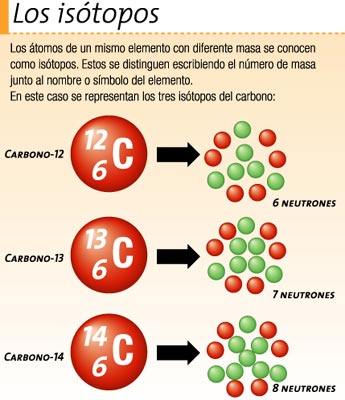
Isótopos
Se denominan isótopos (del griego: lugar) a los átomos de un mismo elemento, cuyos núcleos tienen cantidad diferente de neutrones, y por tanto, difieren en masa. La mayoría de los elementos químicos poseen más de un isótopo. Solamente 21 elementos (ejemplos: berilio, sodio) poseen un solo isótopo natural; en contraste, el estaño es el elemento con más isótopos estables.
Determinación de los pesos atómicos
Los pesos atómicos modernos son calculados a partir de valores medidos de masa atómica (para cada núclido) y la composición isotópica. Están disponibles masas atómicas sumamente precisas[9] [10] para virtualmente todos los núclidos no radioactivos, pero las composiciones isotópicas son más difíciles de medir a un alto grado de precisión, y están sujetas a variación entre muestras.[11] [12] Por esta razón, los pesos atómicos de los veintidós elementos mononuclídicos son conocidos a una precisión especialmente alta, con una incertidumbre de sólo una parte en 38 millones en el caso del flúor, precisión que es mayor que el mejor valor actual para la constante de Avogadro (una parte en 20 millones).
El cálculo es ejemplificado para el silicio, cuyo peso atómico es especialmente importante en metrología. El silicio existe en la naturaleza como una mezcla de tres isótopos: 28Si, 29Si y 30Si. Las masas atómicas de estos núclidos son conocidas a una precisión de una parte en 14 mil millones para el 28Si, y una parte por mil millones para los otros. Sin embargo, el rango de abundancia natural de los isótopos es tal que la abundancia estándar está dada hasta aproximadamente el ±0,001% (ver tabla). El cálculo es
- Ar(Si) = (27.97693 × 0.922297) + (28.97649 × 0.046832) + (29.97377 × 0.030872) = 28.0854
III UNIDAD: LA ENVOLTURA DEL ÁTOMO
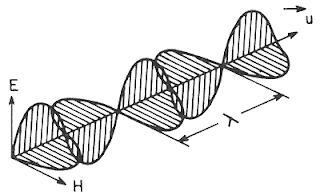
Las ondas electromagnéticas son campos eléctricos (E) y magnéticos (H) variables, oscilantes y mutuamente perpendiculares que se desplazan por el espacio y se relacionan íntimamente con el concepto de energía.
FÍSICA MODERNA
Energía asociada a los cambios de órbita
E fotón absorbido= E(final) - E(inicial) E fotón emitido= E(inicial) - E(final)
LA MECANICA CUANTICA ONDULATORIA
DE BROGLIE " Todo cuerpo en movimiento tiene una onda asociada"
λ = h / m x v = h / p
Número Cuántico Principal.
Número Cuántico Secundario.
Número Cuántico Magnético.
Número Cuántico de Spin.
Número Cuántico Secundario (d)Este número cuántico nos indica en que subnivel se encuentra el electrón, este número cuántico toma valores desde 0 hasta (n - 1), según el modelo atómico de Bohr - Sommerfield existen además de los niveles u orbitas circulares, ciertas órbitas elípticas denominados subniveles. Según el número atómico tenemos los numeros:
l = 0 s sharp
l = 1 p principal
l = 2 d diffuse
l = 3 f fundamental
l = 4 g
l = 5 h
l = 6 i


La interferencia
La difracción
La energía era de naturaleza continua
y la energía electromagnética era proporcional a la amplitud de una onda.
Experimentos cruciales:
Experimentos cruciales:
- El espectro discontinuo de emisión del Hidrógeno.
- El efecto fotoeléctrico.
FÍSICA MODERNA
La energía era de caracter discontinuo
se presenta en forma de pequeños "paquetes de enegía", que se denominan cuantos, cuantas o fotones.
La energía electromagnetica es proporcional a su frecuencia
Ecuación de Planck:
energía de un foton = hv donde h= Constante de Planck = 6,62 10 -27 erg. seg
EL ATOMO DE HIDROGENO DE BOHR
1) Orbitas circulares
2) Momento angular = m e v r = n h / 2 p n = 1,2,3...........a
2) Momento angular = m e v r = n h / 2 p n = 1,2,3...........a
Ciertos valores de r Ciertos valores de E
u órbitas permitidas o niveles de energía permitidos
u órbitas permitidas o niveles de energía permitidos
Energía asociada a los cambios de órbita
E fotón absorbido= E(final) - E(inicial) E fotón emitido= E(inicial) - E(final)
LA MECANICA CUANTICA ONDULATORIA
DE BROGLIE " Todo cuerpo en movimiento tiene una onda asociada"
λ = h / m x v = h / p
NÚMEROS CUÁNTICOS
Los números cuánticos son valores numéricos que nos indican las características de los electrones de los átomos, esto esta basado desde luego en la teoría atómica de Neils Bohr que es el modelo atómico mas aceptado y utilizado en los últimos tiempos.Los números atómicos más importantes son cuatro:
Número Cuántico Principal.
Número Cuántico Secundario.
Número Cuántico Magnético.
Número Cuántico de Spin.
Número Cuántico Principal (n)El número cuántico principal nos indica en que nivel se encuentra el electrón, este valor toma valores enteros del 1 al 7.
Número Cuántico Secundario (d)Este número cuántico nos indica en que subnivel se encuentra el electrón, este número cuántico toma valores desde 0 hasta (n - 1), según el modelo atómico de Bohr - Sommerfield existen además de los niveles u orbitas circulares, ciertas órbitas elípticas denominados subniveles. Según el número atómico tenemos los numeros:
l = 0 s sharp
l = 1 p principal
l = 2 d diffuse
l = 3 f fundamental
l = 4 g
l = 5 h
l = 6 i
Número Cuántico Magnético (m) El número cuántico magnético nos indica las orientaciones de los orbitales magnéticos en el espacio, los orbitales magnéticos son las regiones de la nube electrónica donde se encuentran los electrones, el número magnético depende de l y toma valores desde -l hasta l.
Número Cuántico de Spin (s) El número cuántico de spin nos indica el sentido de rotación en el propio eje de los electrones en un orbital, este número toma los valores de -1/2 y de 1/2. De esta manera entonces se puede determinar el lugar donde se encuentra un electrón determinado, y los niveles de energía del mismo, esto es importante en el estudio de las radiaciones, la energía de ionización, así como de la energía liberada por un átomo en una reacción.
Principio de Exclusión de Pauli
El mismo dice "En un mismo átomo no puede existir dos electrones que tengan los mismos números cuánticos" de esta manera podemos entonces afirmar que en un mismo orbital no puede haber más de dos electrones y que los mismos deben tener distinto número de spin.
Regla de Hund
Cuando se llena orbitales con un mismo nivel de energía o lo que es lo mismo que se encuentran en un mismo subnivel se debe empezar llenando la mitad del subnivel con electrones de spin +1/2 para luego proceder a llenar los subniveles con electrones de spin contrario (-1/2).
Principio de Estabilidad o menor Energía

IV UNIDAD: PROPIEDADES PERIODICAS DE LOS ELEMENTOS
Las propiedades periódicas de los elementos químicos, son características propias de dichos elementos que varían de acuerdo a su posición en la tabla periódica, ósea dependiendo de su número atómico.
Las propiedades periódicas son: electronegatividad, electropositividad, radio atómico, afinidad electrónica, potencial de ionización, la densidad atómica, el volumen atómico, temperatura de fusión y temperatura de ebullición.
Aunque las cuatro ultimas propiedades mencionadas muchas veces son consideradas aperiódicas
Las propiedades mayormente estudiadas son.
Cuadrado periodico
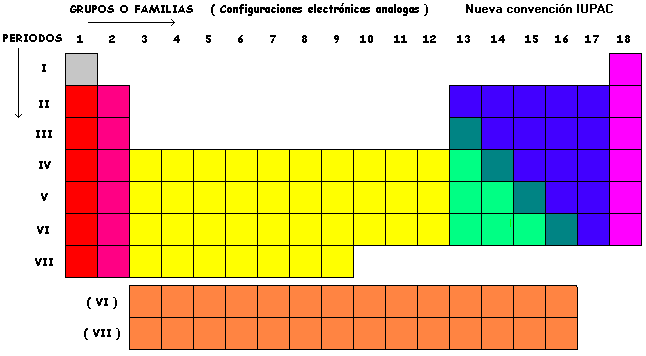
Propiedades periodicas de los elmentos
Electronegatividad
La es la tendencia que un átomo tiene para atraer hacia el los electrones cuando forma un enlace químico.
La electronegatividad tiene la particularidad de no poder ser dimensionada directamente por lo que necesita de otro tipo de cálculos basados en otras propiedades atómicas o moleculares para ser determinada.
La escala de Pauling es una muestra fiel del ejemplo anteriormente mencionado, en ella se define que la electronegatividad crece en la familia de abajo hacia arriba, debido a la disminución del radio atómico y del aumento de intercesiones del núcleo con la electrosfera.
En mención al concepto antes vertido y para determinarlo de forma práctica podemos apreciar que el fluór es el elemento más electronegativo de la tabla periódica.

Electropositividad
La forma de medir la electropositividad es exactamente igual que la utilizada para las mediciones inherentes a su homónimo, mediante un enlace químico.
Entretanto la tendencia dentro de la tabla de elementos es contraria, ya que mide la tendencia de un átomo en perder electrones: Un claro ejemplo son los metales los cuales son los mas electropositivos de la tabla.
La electropositivitad crece en el sentido opuesto a la electronegatividad. De arriba hacia abajo esto nos demuestra que es el Francio anteriormente denominado eka-cesio y actinio K, simbolizado por Fr y de numero atómico 87 el mas electropositivo de la tabla.

Es importante considerar, que los gases nobles son demasiado inertes, por lo que el estudio de los valores de electronegatividad y electropositividad no es objeto de estudio debido a la complejidad que involucra la obtención de los datos.
Radio atómico.
Cuando nos referimos a radio atómico, básicamente planteamos la posibilidad de medir la distancia entre el núcleo de un átomo y la nube de electrones que componen su capa externa.
Las técnicas existentes en la actualidad que permiten generar resultados, son por ejemplo la difracción de neutrones, de electrones o de rayos X, en todo caso es necesario recalcar que no es una propiedad fácil de medir, ya que depende entre otras muchas variables de la especie química en la que se encuentre el átomo.
También es necesario aclarar que existen dos medidas que se pueden tomar dependiendo el caso, podemos obtener radios atómicos covalentes o metálicos, en el caso de los radios covalentes nos referimos a la distancia entre los núcleos de átomos vecinos en moléculas.
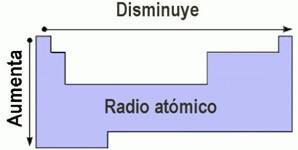
Afinidad Electrónica
La afiniadad electrónica se basa en la medición de la energía liberada por un átomo en estado fundamental y no en estado gaseoso al recibir un electrón.
Además es la energía mínima necesaria para la liberación de un electrón perteneciente a un anión de un determinado elemento.
Los gases nobles no presentan afinidad electrónica relevante, aunque es importante recalcar que nunca igual a 0, la adición de electrones siempre genera liberación de energía.

Potencial de Ionización
El potencial de ionización mide lo inverso a la afinidad electrónica, por lo tanto podemos decir que mida la energía necesaria para retirar un electrón de un átomo neutro en estado fundamental.
Considerando que la energía necesaria para retirar el primer electrón siempre es mayor que la necesaria para retirar el segundo electro que a su vez es menor que la tercera y así sucesivamente.
Presenta el mismo comportamiento que la afinidad electrónica y la electronegatividad.
V UNIDAD: ENLACES QUIMICOS
El enlace químico es la fuerza que une a los atomos para formar las moléculas.
Como ya se ha dicho es un proceso de estabilización por interacciones electrónicas donde cada átomo trata de alcanzar la configuración electrónica del gas noble más cercano. Por lo general los gases nobles tienen 8 electrones de valencia, de allí se acostumbra a decir que el enlace químico se forma cumpliendo la "regla del octeto".
La energía de estabilización se denomina también la energía de enlace y corresponde además de la energía liberada cuando se forma el enlace a la energía necesaria para romper el enlace.

Regla del octeto y estructura de Lewis
A inicios del siglo XX, en 1916, de manera independiente, los científicos Walter Kossel y Gilbert Lewis concluyeron que la tendencia que poseen los átomos de lograr estructuras similares a las del gas noble más cercano explica la formación de los enlaces químicos. Esta conclusión es mundialmente conocida como la Regla del Octeto y se enuncia de la siguiente manera:
“Cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho electrones, y así adquiere la estructura electrónica del gas noble más cercano en el sistema periódico”.
No obstante, hay muchas excepciones a esta regla y hasta se han logrado sintetizar algunos compuestos de los gases nobles.
¿Cómo diseñar una estructura de Lewis?
La estructura de Lewis permite ilustrar de manera sencilla los enlaces químicos, en ella, el símbolo del elemento está rodeado de puntos o pequeñas cruces que corresponden al número de electrones presentes en la capa de valencia.
Tipos de enlaces quimicos
Existen dos mecanismos para cumplir la regla del octeto.
1.ENLACE IONICO. Cesión de electrones, de parte de un átomo fuertemente electropositivo a otro fuertemente electronegativo. Formación de iones positivos y negativos y atracción electrostática entre ellos.
2.ENLACE COVALENTE. Compartición de parejas de electrones entre átomos de parecida o igual electronegatividad. Electrones compartidos con spines opuestos y atracción magnética.
Se presenta con relativa frecuencia la situación que para formar un enlace covalente o de compartición, es uno de los átomos participantes del enlace el que aporta la pareja de electrones del enlace. El enlace que se forma se llama covalente dativo y va acompañado de desbalances de cargas eléctricas que deben ser determinados para tener una clara visión de la situación molecular.
Los desbalances de cargas eléctricas se detectan mediante el cálculo de las cargas formales haciendo uso de la siguiente relación:
CF = N° de electrones de valencia - ( N° electrones no enlazantes + 1/2 N° electrones enlazantes )
Algunos ejemplos:
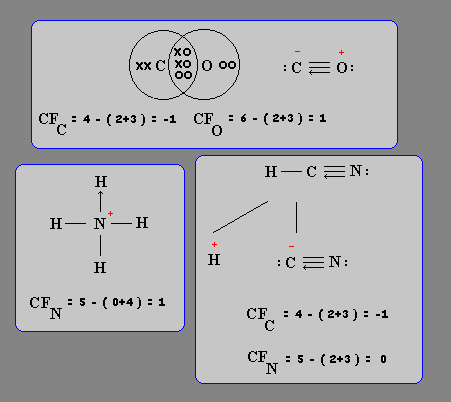
TIPOS DE UNIONES
Los gráficos siguientes además de reforzar los conceptos de orbitales moleculares enlazantes y antienlazantes y sus implicancias desde el punto de vista de la energía nos muestran dos situaciones que apuntan más bién al tipo de orbitales que intervienen o a distintas formas de unión.
 |
| orbital tipo P |
TIPOS DE ENLACES Y UNIONES
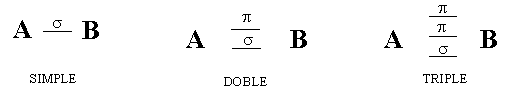
Geometría molecular
La geometría molecular o estructura molecular se refiere a la disposición tri-dimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, como son la reactividad, polaridad, fase, color, magnetismo, actividad biológica, etc. Actualmente, el principal modelo de geometría molecular es la Teoría de Repulsión de Pares de Electrones de Valencia (TRePEV), empleada internacionalmente por su gran predictibilidad.Las geometrías moleculares se determinan mejor a temperaturas próximas al cero absoluto porque a temperaturas más altas las moléculas presentarán un movimiento rotacional considerable. En el estado sólido la geometría molecular puede ser medida por Difracción de rayos X. Las geometrías se pueden calcular por procedimientos mecánico cuánticos ab initio o por métodos semiempíricos de modelamiento molecular. Las moléculas grandes a menudo existen en múltiples conformaciones estables que difieren en su geometría molecular y están separadas por barreras altas en la superficie de energía potencial.
La posición de cada átomo se determina por la naturaleza de los enlaces químicos con los que se conecta a sus átomos vecinos. La geometría molecular puede describirse por las posiciones de estos átomos en el espacio, mencionando la longitud de enlace de dos átomos unidos, ángulo de enlace de tres átomos conectados y ángulo de torsión de tres enlaces consecutivos.
VI UNIDAD: LAS PROPIEDADES FISICO-QUÍMICAS DE LAS SUSTANCIAS PURAS
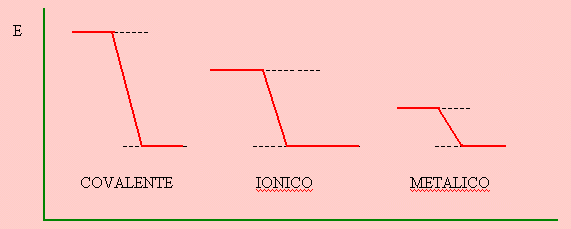
Los tipos de enlaces, la direccionalidad de éstos, los rasgos eléctricos y otras características moleculares determinan las propiedades fisicoquímicas de las sustancias.
Parece conveniente referirse en éste momento a la fortaleza comparada de los distintos tipos de enlaces interatómicos. La fortaleza del enlace está dada por la energía necesaria para romper el enlace y ésta a su vez es directamente proporcional a la energía de estabilización o energía liberada cuando el enlace se forma.
El enlace covalente es el más fuerte, lo sigue el iónico y finalmente el metálico que es el más débil.
MOLECULAS GIGANTES
Son arreglos de átomos, unidos mediante fuerzas de enlace químico (interatómico), en que no está definido el tamaño del sistema. Por lo general son arreglos de gran tamaño y de allí el nombre de la categoría. La proporción de distintos átomos se conoce y se representan estos sistemas por su fórmula empírica. La fórmula verdadera es (F.E.) n , pero n es indeterminada.
Hay tres grandes tipos de moléculas gigantes, las de enlace iónico, las de enlace covalente y las de enlace metálico.
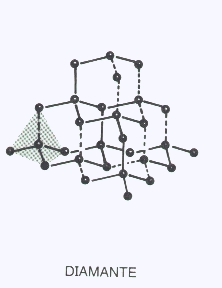
COVALENTES TRIDIMENSIONALES
Son arreglos tridimensionales de átomos iguales o diferentes unidos por enlaces covalentes y dispuestos en el espacio siguiendo las reglas de la hibridación. Son las estructuras más rígidas, duras o resistentes que se conocen.
Sus temperaturas de fusión son muy altas ( miles de°C) y en muchos casos se descomponen químicamente por el calor antes de entrar en fusión. Por otra parte la separación de las partículas por acción de moléculas de un solvente es imposible, por lo tanto son completamente insolubles.
El Carbono en su forma de diamante ( hibridación sp3 ) es un ejemplo típico de ésta categoría. Las láminas de Silicio de la nariz del Discovery son otro ejemplo.
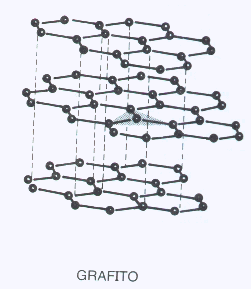
COVALENTES BIDIMENSIONALES
Es cuando la red de enlaces covalentes se teje en dos dimensiones. Los mismos conceptos de infusibilidad e insolubilidad que para las mallas trididimensionales pero no así en lo que se refiere a la dureza pues las fuerzas de atracción entre las mallas bidimensionales es débil. Por esa razón estas sustancias son blandas en el sentido del desprendimiento de las mallas.
El ejemplo típico es el Carbono en su forma de grafito en que los C están hibridizados sp2 . Es interesante consignar que en cada orbital pz existen un electrón. Estos electrones se pueden desplazar sobre la malla y en consecuencia el grafito es conductor de la corriente eléctrica.
COVALENTES UNIDIMENSIONALES
Corresponde a las sustancias denominadas polímeros, largas cadenas de unidades conectadas por enlaces covalentes.
Los homopolímeros que repiten unidades iguales (-A-A-A-A-A-A- ; -(A)- n ).
Los copolímeros que repiten unidades distintas ( A-B-A-B-A-B- ; ( -A-B-) n ).
Son cadenas largas llamadas también macromoléculas y por ésta razón es que interaccionan unas con otras de manera significativa. Las interacciones entre macromoléculas son fuerzas de distintos tipos y que veremos más adelante en el caso de moléculas pequeñas.
En los polímeros, en primer término, la fusión y la solubilización están determinadas por la magnitud de las fuerzas de atracción entre las macromoléculas, en principio altas, precisamente por la longitud de las cadenas. Sin embargo, existe un segundo factor determinante, el factor entrópico o desorden que pueden alcanzar las estructuras una vez solubilizadas o fundidas.
Los polímeros flexibles o plegables forman estructuras sólidas bifásicas (cristalinas – amorfas) que son quebradizas, éstas estructuras se pueden disolver o fundir con relativa facilidad pues cuando alcanzan tales estados la macromoléculas están muy enroscadas, plegadas u ovilladas, en suma desordenadas lo que favorece el proceso de separación de las macromoléculas.
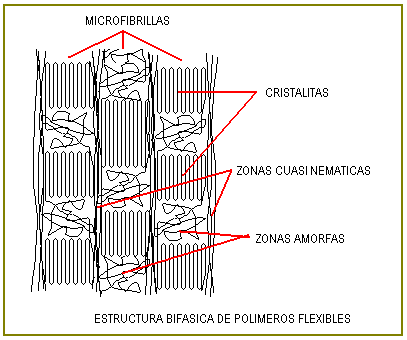
En cambio, las macromoléculas rígidas no tienen favorable el factor entrópico y así son dificiles de fundir y solubilizar. Estos polímeros rígidos, en el sólido son monofásicos y de mucha resistencia ( Kevlar).
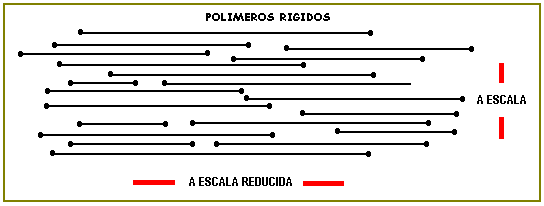
En la práctica un gran número de macromoléculas se encuentran entre estas dos situaciones extremas y el grado de endurecimiento o ablandamiento depende de las temperaturas a que se encuentran sometidos los sistemas.
Los procesos de ablandamiento sobrevienen en zonas de temperaturas bien definidas para cada tipo de macromoléculas.
Muchas veces las cadenas macromoléculares sintéticas o naturales se conectan entre sí mediante átomos o grupos de átomos enlazados covalentemente ( polímeros reticulados) con propósitos tecnológicos precisos. En estos casos las estructuras resultantes semejan a las redes covalentes bi o tridimensionales y así también son sus propiedades, nula solubilidad y puntos de fusión demasiado elevados que amenazan la estabilidad química de las sustancias.
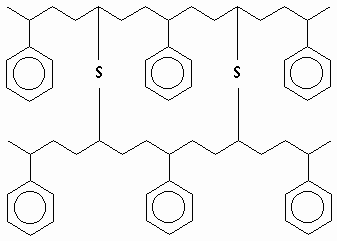
Copolímero de estireno-butadieno (neumáticos) vulcanizado con S.
Este tipo de productos son difíciles de recuperar y reutilizar ( Reciclaje) precisamente por las razones ya mencionadas y constituyen un problema para la ecología por la contaminación del ambiente.
 La celulosa es un polímero natural de características estructurales semirígidas y si a ello agregamos que entre las cadenas macromoleculares existen fuerzas de atracción, de alta magnitud como los puentes de H debido a la presencia de mucho grupos de -OH son comprensibles las dificultades para la fusión y la solubilización.
La celulosa es un polímero natural de características estructurales semirígidas y si a ello agregamos que entre las cadenas macromoleculares existen fuerzas de atracción, de alta magnitud como los puentes de H debido a la presencia de mucho grupos de -OH son comprensibles las dificultades para la fusión y la solubilización. Estructura tipo celulosa
IONICAS.
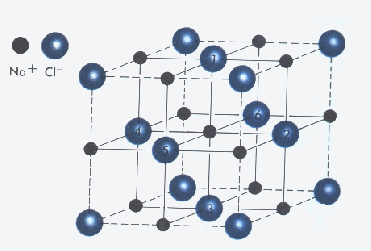
En estas moléculas gigantes los átomos están unidos por enlaces iónicos. Es decir son un arreglo de iones positivos y negativos que se disponen alternadamente en el espacio compensando sus cargas . La geometría del arreglo es simple cuando los iones positivos y negativos son monoatómicos y además se encuentran en relación 1:1 como en el caso del Na+Cl -. Cuando los iones son complejos, con grandes diferencias de tamaños o la proporción entre ellos no es simple, los arreglos son complicados y son materia de estudio de la Cristalografía que hace uso de las técnicas de difracción de rayos X para resolver estas situaciones.
Son estructuras de temperatura de fusión elevadas , alrededor de los 1000°C de acuerdo a la fortaleza del enlace iónico. En estado sólido o cristalino, donde los iones se encuentran atrapados no conduce la corriente eléctrica, pero sí la conducen en estado fundido.
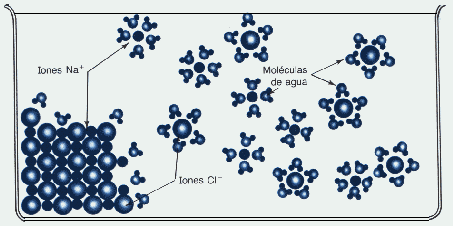
Estas estructuras pueden ser solubilizadas, aunque no siempre, mediante solventes con moléculas polares como el caso de agua. Las moléculas del solvente rodean los iones apuntando sus fracciones de carga al ión de carga opuesta. Así los iones solvatados son separados al debilitarse el enlace iónico. De ésta forma los iones disueltos (móviles) constituyen partículas para el flujo eléctrico.
METALICAS
Corresponde al caso de los metales. Los átomos metálicos , al ser muy electropositivos se desprenden de sus electrones de valencia pasando a formar iones positivos. Por su parte los electrones que han perdido su pertenencia a un átomo determinado se mueven entre los iones constituyendo una nube de electrones delocalizados. Esta nube de electrones que une a iones positivos es el enlace metálico.
Ya nos hemos referido a la fortaleza del enlace metálico y podemos generalizar diciendo que los puntos de fusión de los metales son medianamente altos. Señalemos que metales como el Hg, Cs, y Fr son líquidos a temperatura ambiente.
La naturaleza de movilidad del enlace metálico confiere a los metales su blandura, es decir los convierte en dúctiles y maleables.
La movilidad de los electrones se traduce en la capacidad de conducción de la corriente eléctrica y también es responsable de la conductividad térmica.
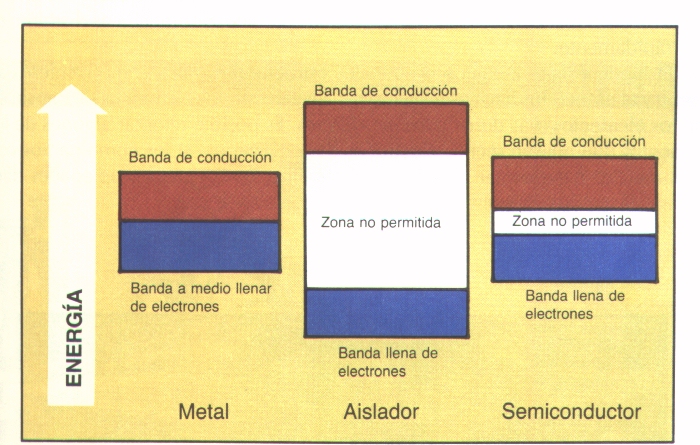
Es interesante observar la relación entre las conductividades eléctricas y térmicas y la situación de los diagramas de energía de los orbitales llenos y vacíos de metales y no metales. Los metales promueven sus electrones de valencia de orbitales s a los orbitales p vacíos que se encuentran energéticamente cercanos formando éstos últimos orbitales o bandas de conducción. Por el contrario, los no metales tienen los electrones en orbitales p y los orbitales s siguientes vacíos se encuentran energéticamente lejanos por lo que no se produce la promoción y los electrones permanecen ligados a sus respectivos átomos.
MOLECULAS CONVENCIONALES
O SUSTANCIAS MOLECULARES
Son aquellos sistemas formados por moléculas que se encuentran claramente definidas, se conoce el número exacto de átomos y de qué elementos está constituída la molécula. Se representan por las llamadas fórmulas moleculares reales.
En su gran mayoría las moléculas de ésta categoría unen sus átomos con enlaces covalentes y al expresar esto pensamos en muchas moléculas simples formadas entre no metales y en la inmensa cantidad de compuestos orgánicos constituídos principalmente por los elementos C, H, O, N, P, S.
Sin embargo al momento de racionalizar las propiedades fisicoquímicas de este tipo de estructuras, el tipo de enlace interatómico ( covalente) y su fortaleza no cuenta pués en este caso lo determinante son las fuerzas entre moléculas o fuerzas intermoleculares y en algunos casos son fuerzas intramoleculares ( fuerzas dentro de las moléculas; pero no interatómicas o de enlace químico ) las determinantes de las propiedades.
En todo caso las fuerzas intermoleculares son de naturaleza eléctrica, pero las hay de diferente naturaleza y magnitudes pero siempre dependen en definitiva de las características eléctricas, del tamaño y geometría de las moléculas.
VII UNIDAD: EL CONCEPTO DE MOL Y SUS APLICACIONES
El valor 6,023 10exp23 fué determinado por Avogadro mediante cálculos estadísticos acerca de sistemas gaseosos y de ahí que se reconoce como el Número de Avogadro ( N ).
N = 6,023 .10exp 23
Este valor pasa a ser de importancia central en la química cuantitativa y es la base de la definición del concepto de mol.
N = 6,023 .10exp 23
Este valor pasa a ser de importancia central en la química cuantitativa y es la base de la definición del concepto de mol.
DEFINICIÓN DE MOL Un Mol es 6,023 10 23 unidades:
Cantidad de sustancia que contiene el mismo número de unidades elementales (átomos, moléculas, iones, etc.) que el número de átomos presentes en 12 g de carbono 12.
Cuando hablamos de un mol hablamos de un numero especifico de la materia. Por ejemplo si decimos una docena sabemos que sin 12, una centena 100. Este número se conoce como Número de Avogadro y es un número tan grande que es dificil imaginarlo.
ECUACIÓN DE LOS GASES IDEALES:
Para dar adecuada respuesta a la pregunta planteada es necesario averiguar las relaciones matemáticas que expresan el comportamiento de las dis
 |
| Moles de algunos elementos |
ECUACIÓN DE LOS GASES IDEALES:
Para dar adecuada respuesta a la pregunta planteada es necesario averiguar las relaciones matemáticas que expresan el comportamiento de las dis
tintas variables que determinan el estado de un sistema gaseoso. Un sistema gaseoso se encuentra en un estado definido cuando, además de precisarse la naturaleza del gas, se conocen tres de las siguientes cuatro variables:
Volumen atómico molar (Vam)
Se refiere al volumen ocupado por un mol de átomos. Dicho de otro modo, el volumen atómico molar corresponde a los centímetros cúbicos ocupados por un mol de átomos:
1 mol de átomos en estado gaseoso ocupa un volumen (en condiciones normales) de 22,4 litros. |
Las condiciones normales son presión a 1 atm (atmósfera) y temperatura a 0º C. Si estas condiciones cambian, el volumen cambiará.
Ahora bien, para conocer cuántos moles hay de un átomo o molécula en una determinada cantidad de materia (masa, en gramos) es necesario saber cuántos gramos hay de dicha materia y conocer su peso atómico o molecular.
Usando la siguiente igualdad:
| mol = | Gramos del átomo o molécula |
| Peso atómico o Peso Molecular |
que se lee mol es igual a gramos del átomo o molécula dividido por el peso atómico o peso molecular.
Ejemplo:
Tenemos 23 gr. de Na y el peso atómico del Na es 23 gr.
Gramos del átomo o molécula Na
mol= Peso atómico o peso molecular Na
Otro ejemplo:
Tenemos 2,21 moles de una sustancia y sabemos que su peso molecular es 40 gr.
¿Cuántos grs. Tenemos de la sustancia?
De la igualdad sabemos:
| 2,21 moles = | X Gramos del átomo o molécula |
| 40 Peso atómico o Peso Molecular |
Despejando X (los gramos) obtenemos 2,21 moles x 40 gr. = 88,4 gr.
Otro ejemplo:
Tenemos 100 gr. de agua y sabemos que el peso molecular (PM) del agua es 18 gr. ¿Cuántos moles de agua tenemos?
| mol = | 100 Gramos del átomo o molécula agua |
| 18 Peso atómico o Peso Molecular agua |
Despejamos la ecuación: 100/18 nos da 5,55 cc/mol (moles)
Otros ejemplos:
- Calcule el volumen atómico molar si la densidad es 0,36 gr/cc y la masa es 50,31 gr/mol.
- Determine el volumen atómico molar si la masa atómica es 7,26 gr/mol y la densidad es 10,3 gr/cc.